50 оттенков биотехнологий

Мы публикуем стенограмму лекции популяризатора науки, кандидата биологических наук, старшего научного сотрудника Института проблем передачи информации РАН, члена Совета Фонда «Эволюция» Александра Панчина, состоявшейся 4 февраля 2016 года в Библиотеке-читальне имени И.С. Тургенева.
Борис Долгин: Добрый вечер. Мы начинаем очередную лекцию цикла «Публичные лекции Полит.ру». Наш сегодняшний гость – научный сотрудник института проблем передачи информации РАН, с одной стороны – профессиональный ученый, с другой стороны – не менее опытный популяризатор науки в разных формах: от устной, с которой мы познакомимся сегодня, до письменной – мы видим на столе относительно недавно вышедшую книгу «Сумма биотехнологии», Александр Панчин. Александр является также членом совета фонда «Эволюция».
Какое-то количество ученых и популяризаторов науки по мере того, как стало ясно, что фонд «Династия» будет ликвидирован, решило, что не должно остаться пустое место на площадке информационной, методической, финансовой, организационной координации разных форм деятельности популяризации науки – и создали этот самый фонд. Заходите на его сайт, чтобы понять, как это устроено, самим поучаствовать, понять, насколько вы можете доверять рекомендациям фонда, исходя из состава Совета. А он будет призван становиться некоторым рекомендательным центром. Можете поучаствовать в деятельности фонда личным образом.
Но сегодня мы не о фонде, не об эволюции в ее естественных формах, а о том, что делается руками человека, искусственно. Некоторые люди очень пугаются того, что делается искусственно. Пытаются все время найти что-нибудь естественное. Сегодня мы как раз поговорим о биологической части этой проблемы.
Александр Панчин: Спасибо! Очень приятно, что сегодня пришло столько народу. Для начала – вы видите здесь картины известных художников, нарисованные с помощью генетически модифицированных бактерий, в которые были внесены гены различных флуоресцентных белков, они светятся, может быть, вы даже могли некоторые картины узнать. Вот так они выглядят в оригинале.
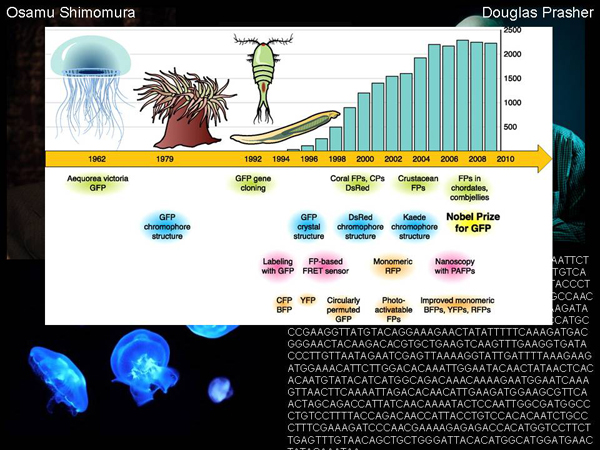
Для того, чтобы такие картины рисовать с помощью генетически модифицированных бактерий, ученым нужно было открыть ген флуоресцентного белка. Вначале был открыт сам белок, открыл его Осамо Шимамура (Osamu Shimomura), который изучал светящихся медуз, и вначале нашел у них белок, которые испускает синий свет, осуществляя определенную химическую реакцию, а потом нашел белок, который поглощает синий свет, и испускает зеленый.
Если мы посмотрим на хронологию того, что происходило дальше, мы увидим, что с 1962 года было очень малое количество публикаций, посвященных этому самому зеленому белку. Вообще, эта тема мало, кого интересовала, кроме узкой группы ученых, которые про этот белок узнали всё: как он устроен, какая у него структура, какова физика процесса, как он поглощает и испускает свет. Но это была чистая фундаментальная наука, не имеющая никакого прикладного значения.
Но что-то произошло, и начался рост количества публикаций по этой теме. Количество публикаций растет, и в 2008 Нобелевскую премию по химии дают за открытие этого белка. Что же случилось, из-за чего начало расти количество публикаций? А случилось то, что был открыт ген этого флуоресцентного белка, последовательность ДНК, которая отвечает за его синтез.
Здесь изображена эта последовательность. Открыл ее ученый Дуглас Прашер (Douglas Prasher). Как только была обнаружена эта последовательность ДНК, оказалось, что ее можно переносить в другие организмы и заставлять их светиться. Можно переносить ее в определенный генетический контекст, чтобы смотреть, где и в каких клетках работают те или иные гены, по свечению. И появился такой мощный инструмент, который до сих пор используется в молекулярной биологии для фундаментальных и прикладных исследований.
К сожалению, Дуглас Прашер не смог добиться хорошего финансирования и предположил, что не сможет дальше в полной мере изучать ген, который он открыл. И он передал этот ген – буквально в пробирке – двум своим коллегам, Мартину Чалфи (Martin Chalfie) и Роджеру Тсьену (Roger Y. Tsien), которые получили Нобелевскую премию. Вместе с Осамой Шимомура. Вот такая грустная история – человек, открывший ДНК флуоресцентного белка, Нобелевскую премию не получил.
Мартин Чалфи тоже не был богатым ученым, но он был изобретательным ученым. Есть такая история: им нужно было где-то взять флуоресцентный микроскоп, который мог бы детектировать это зеленое свечение, но денег не было. И они приглашали в свою лабораторию торговцев микроскопами, которые присылали своих представителей с микроскопами – проверить, всё ли работает. Они брали микроскоп, быстро проводили свои исследования, а потом говорили, что им не подошел этот микроскоп.
И так они накопили данные на публикацию в журнале «Science». Вот здесь показан круглый червь, внутри которого работает ген флуоресцентного белка в тех клетках, которые отвечают за способность организма реагировать на физические прикосновения. И они показали, что этот флуоресцентный белок можно переносить в другие организмы, и с помощью его изучать, как и где и какие гены работают в организме.
А этого ученого зовут Роджер Тсьен. В его лаборатории брали ген зеленого флуоресцентного белка и переносили в различные бактерии, которые потом заставляли размножаться, и отбирали те бактерии, которые из-за каких-то случайных мутаций начинали светиться как-то по-другому: более ярко, или в более синем диапазоне, или в более красном диапазоне. Они делали селекцию и с помощью такой «эволюции в пробирке» они получили бактерии с другими генами флуоресцентных белков. И вот этими бактериями и нарисованы эти вот картины.
Мартин Чалфи, Роджер Тсьен и Осама Шимомура получили Нобелевскую премию, а, поскольку больше, чем трем людям, ее не дают, Дуглас Прашер был почетным гостем на церемонии («Полит.ру» – Тсьен и Чалфи оплатили Прашеру и его жене авиабилеты и гостиницу, чтобы он смог присутствовать на Нобелевском банкете).
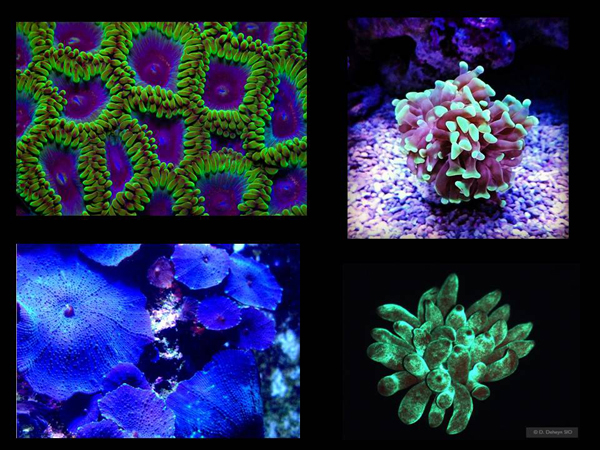
Чем тем временем занимались российские ученые? «Под покровом ночи» на яхте, с пачкой презервативов и детектором поддельных банкнот они вершили науку. Да, как ни странно, всё это было исключительно в научных целях. Хотя у берегового патруля и были к ним вопросы, с документами у них было все в порядке. Они брали детектор поддельных банкнот, помещали его в презерватив, чтобы не намок и, ныряя, светили ультрафиолетом на различную подводную жизнь, в частности – на кораллы под водой. И смотрели, какие из них светятся.
Потом брали у этих организмов образцы ДНК, чтобы найти там другие гены флуоресцентных белков. Вы можете создавать новые флуоресцентные белки в лаборатории с помощью эволюционирующих бактерий, а можете делать это, выискивая уже готовые, придуманные природой решения в окружающей среде.
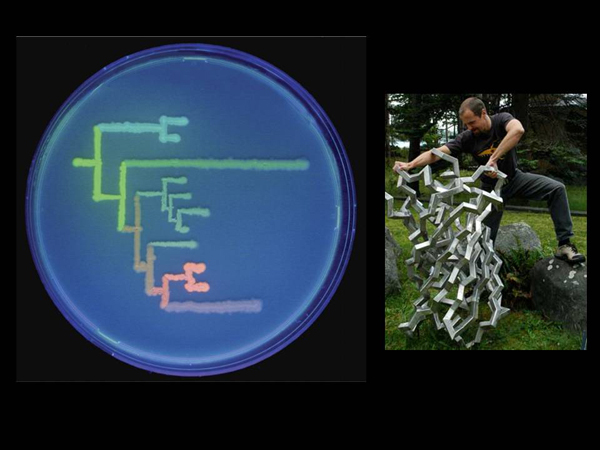
Вообще, по-видимому, одна из главных задач генной инженерии – найти замечательные гены, которые дальше можно использовать, ведь в природе уже придумано много хорошего. Соответственно, что они делали дальше? Вот здесь один из этих ученых Михаил Матц – разрывает структуру зеленого флуоресцентного белка, а слева – картинка из их публикации.
Что они делали? Вот это – эволюционное дерево, показывающее родство между некоторыми генами флуоресцентных белков. Нарисовано это дерево бактериями, в которых есть гены флуоресцентных белков. Как мы знаем из теории эволюции, когда-то у всех живых организмов был общий предок. Точно так же, когда-то у живых организмов с разными флуоресцентными белками когда-то был общий предок, который впервые «придумал» какой-то флуоресцентный белок. А потом его потомки этот белок модифицировали, и получились разные цвета.
И вот, используя методы математической биологии, биоинформатики, мы можем реконструировать эту эволюцию, можем посмотреть, какие сейчас есть варианты этих генов, и предсказать, какие варианты были у очень далеких организмов, которые жили раньше и сейчас уже не существуют.
«Края» этого дерева, эти «листья», нарисованы с помощью бактерий, в которых находятся гены реально существующих белков. А в узлах находятся бактерии с генами, которые были реконструированы. То есть, ученые взяли, предсказали на компьютере, какая должна быть последовательность гена, после этого они синтезировали его в пробирке, «вставили» в бактерию и посмотрели, как он светится. По тому, как он светится, можно сказать, какого цвета он был.
В данном случае – видите – есть такие коричневатые, салатовые? Это «предковые» формы. Может быть, были еще более древние. Есть в науке такой жаргон: ученые, которые занимаются «мокрой» биологией – они капают что-то в пробирки, а есть «сухие» биологи, вроде меня, которые сидят за компьютерами и анализируют готовые биологические данные. И вот здесь объединяются подходы настоящей «мокрой» биологии – этот человек настоящий мокрый биолог, он действительно нырял под воду ради науки, и сухой биологии, чтобы получить еще один подход к получению этих флуоресцентных белков.
И вот, собственно, декоративное значение зеленого флуоресцентного белка – всякие красивые зверюшки. Есть раздел искусства, где это используется. Есть такой художник – Эдуардо Кац (Eduardo Kac), который придумал следующую штуку. В бактерии, в которых находится ген флуоресцирующего белка, внесена еще определенная конструкция.
Конструкция выглядит следующим образом: была взята цитата из Библии на английском языке, с помощью определенного шифра переведена в азбуку Морзе, которая была переведена в последовательность нуклеотидов, из которых состоит молекула ДНК – А, Т, G, С и так далее. После этого последовательность вместе с геном зеленого флуоресцентного белка была внесена в бактерии, и этим бактериям было дано время, чтобы они размножались. Зеленый флуоресцентный белок – просто как маркер, что там есть эта вставка.
Этим бактериям дали какое-то время, чтобы те мутировали, а потом прочитали последовательность ДНК, которая получилась в результате этих мутаций. И получили новую последовательность ДНК, которую перевели в азбуку Морзе, из которой сделали текст. И в этом тексте есть ошибки.
И вот этот Эдуардо Кац говорит, что эта метафора – что мутация в генетическом материале ДНК как опечатка в тексте. Что можно посмотреть под таким углом. Соответственно, опечатки бывают разные. Иногда опечатка в тексте приводит к чему-то незначительному: например, вместо «Саша ехала на мотоцикле» вы говорите: «Маша ехала на мотоцикле». Вы получаете похожий по смыслу текст и, может быть, даже правильнее описывающий реальность.
Но бывает всякая ерунда: если вы сделаете слишком много мутаций, то можете получить «Каша ехала на котоцикле». А когда организму становится плохо, то это уже случилась вредная мутация.
Можно развить эту метафору дальше, как я попытался её развить. Можно представить перенос гена из одного организма в другой как перенос кусочка текста из одного текста в другой. Вот перенесем кусок из «Войны и мира» в «Войну миров». «…Большая сероватая круглая туша, величиной, пожалуй, с медведя, медленно и трудно вылезала из цилиндра. Высунувшись на свет, она залоснилась, точно мокрый ремень. Два больших тёмных глаза пристально глядели на меня… У чудовища была кругла голова и, если можно так выразиться, лицо. Под глазами находится рот, края которого двигались и дрожали, пуская слюну. Чудовище тяжело дышало, и все его тело судорожно пульсировало. Одно его тонкое щупальце упиралось в край цилиндра, другим оно размахивало в воздухе… Этот толстый молодой человек был незаконный сын знаменитого екатерининского вельможи, графа Безухова».
Перенесли один осмысленный фрагмент, получили – другой осмысленный фрагмент. Собственно, вот чем занимается генная инженерия.
Это было искусство, а теперь – фундаментальная наука. Здесь на слайде показана картинка такой «штуки», которая называется brainbow – «мозговая радуга». Brain – мозг, rainbow – радуга. Сверху – срез мозга грызуна, снизу – срез мозга мушки дрозофилы. Была придумана такая штука: можно взять и внести в ДНК организма грызуна огромное количество разных копий разных генов флуоресцентных белков.
И дальше была придумана некая технология, которая позволяет сделать так, чтобы по мере развития этого организма некоторые копии этих генов «выключались», переставали работать. Это происходило по-разному, в разных клетках. В итоге в разных клетках образуются разные сочетания генов флуоресцентных белков. И точно так же, как мы получаем огромную палитру оттенков цветов, смешивая красный, синий и зеленый цвет, точно также здесь возникает огромная палитра «оттенков» отдельных клеток. И мы можем, посмотрев на нервную систему, теперь понять, как какая нервная клетка связана с другой, потому что у нервной клетки есть тело, есть отростки, и очень тяжело в этой запутанной схеме было понять, где эти отростки, куда они ведут.
Но теперь вы видите, что от этой клетки желтый отросток ведет вот сюда. И вы понимаете, что вот эта клетки иннервирует эту часть тела вот этого организма, ну и так далее.
Теперь мы поговорим о том, как биотехнологии могут быть использованы для того, чтобы улучшить, в частности, жизнь человека, других живых организмов. Наверное, все слышали новость: в Великобритании разрешили проводить опыты по созданию генетически модифицированных эмбрионов человека при условии, что они потом не будут никуда имплантироваться.
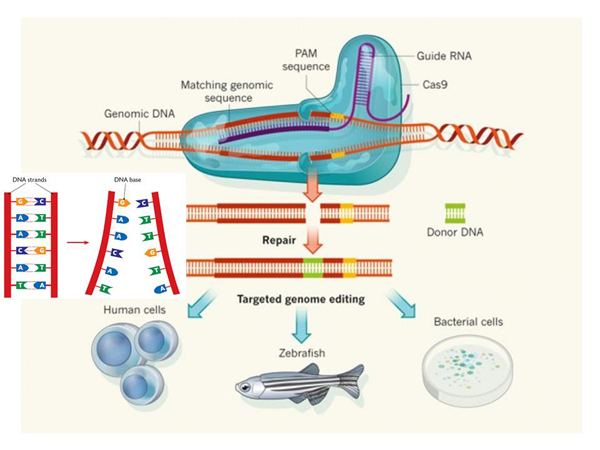
Немного раньше была публикация ученых из Китая, которые уже сделали генетически модифицированные эмбрионы, которые никуда не имплантировались, и были сделаны с помощью специальной технологии, которая называется «CRISPR/Cas9» – это метод редактирования ДНК, о котором я позже расскажу.
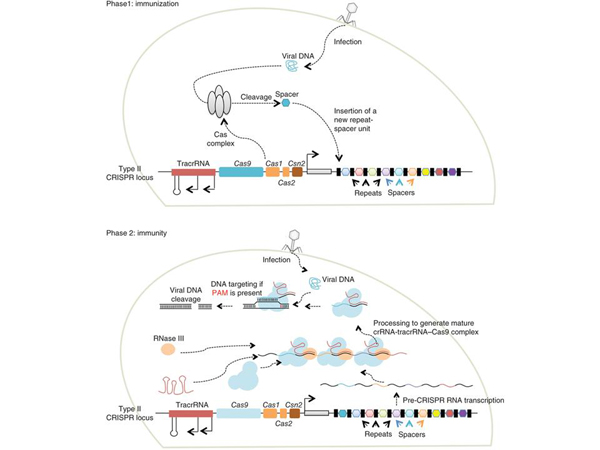
Собственно, сейчас развивается идея, что мы можем генетически модифицировать эмбрионы. Когда научимся делать это хорошо, может быть, сможем воплотить все это в практику. Что за технология была использована этими китайскими учеными? Они используют некоторую систему, которая существует в природе у бактерий. Она была обнаружена при попытке сделать более вкусный, менее портящийся йогурт.
В ходе изучения молочнокислых бактерий, которые создают йогурт, была обнаружена ранее неизвестная система иммунитета. Эта система устроена следующим образом: вирус впрыскивает свою ДНК в бактериальную клетку. У бактерий есть специальный механизм, который кусочек этой вирусной ДНК встраивает в свою ДНК. Вот тут видны такие красные, синие «штучки» – это остатки фрагментов разных вирусов, с которыми когда-то сталкивались предки этой бактерии. Некая «антивирусная база данных» вирусов, с которыми бактерии сталкивались раньше.
Дальше синтезируются множества копий, фрагментов, похожих на эту вирусную «вставку», только уже не ДНК, а РНК. Некая промежуточная молекула между ДНК и белком. В данном случае, никакого белка не производится, РНК узнается специальным белком, который берет эту РНК и с помощью нее начинает искать другие «вставки» похожих вирусов. И их уничтожать.
Вот вирусная инфекция, вот некоторый механизм, который «вырезает» из вируса кусочек, который называется спейсером, и этот спейсер встраивается в ДНК этой бактерии, то есть, бактерии, по сути, занимаются генной инженерией самих себя. Вот набор разных вирусов, видите – они разного цвета. И потом синтезируется РНК, она связывается с белком, и этот белок, как ключ в замке, пытается искать другие вирусные последовательности, чтобы их найти и разрезать. Было ли понятно то, что я сейчас рассказал? Если кому-то было непонятно, можно спросить сейчас.
Борис Долгин: И это – единственное исключение, когда можно спросить.
Александр Панчин: Так вот, для чего это можно дальше использовать? Забудем сначала про эмбрионы. Возьмем растения. Бактерии на протяжении сотен миллионов лет эволюции – а может быть, и больше, этот механизм очень долго отлаживался – теперь мы его можем взять и перенести в другой организм.
Например, в растения, у которых нет такого механизма иммунитета. Была опубликована недавно работа, где взяли и сделали растения, устойчивые к вирусу, благодаря тому, что в них перенесли этот механизм бактериального иммунитета. Понятно, что можно это использовать для очень разных целей.
Но одна из вещей такая: если мы научились делать точное место разреза в ДНК, то мы можем научиться и что-то очень точно туда встраивать, получая различные генетически модифицированные организмы, от бактерий до людей.
Здесь показан механизм, как работает механизм «CRISPR/Cas9». Вот эта красненькая – это ДНК, в которой мы хотим сделать разрез. А вот это – так называемая «путеводная РНК», РНК бактерии, похожая на кусок вируса, который она должна распознать. Распознавание происходит вот здесь.
Вот эти зубчики образуют комплементарные связи. В молекуле ДНК комплементарные связи выглядят так: А стоит напротив Т, и G стоит напротив С. И образуется двойная спираль молекулы ДНК. А в РНК тоже очень похожая штука, просто вместо Т – U, но важно то, что тоже образуются комплементарные связи, напротив одной буквы стоит другая. И, благодаря этим связям, распознается определенное место в ДНК.
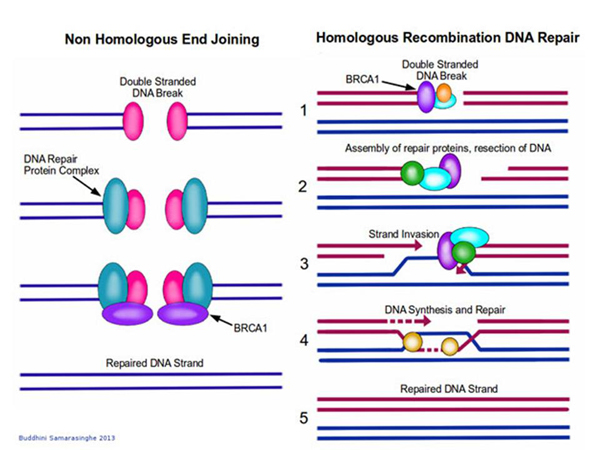
Это может быть какая-то геномная ДНК, и этот белок делает здесь разрез. Разрез образуется, и дальше мы хотим туда что-то вставить. Как? Для этого используется механизм, который тоже существует в наших клетках, он называется «механизм гомологичной рекомбинации».
Что это значит? Вот у нас есть ДНК. Всё то же самое, просто двойную спираль превратили в цепочку, чтобы вам было удобнее смотреть. Этот «CRISPR/Cas9» разрезает вот здесь, в молекуле ДНК.
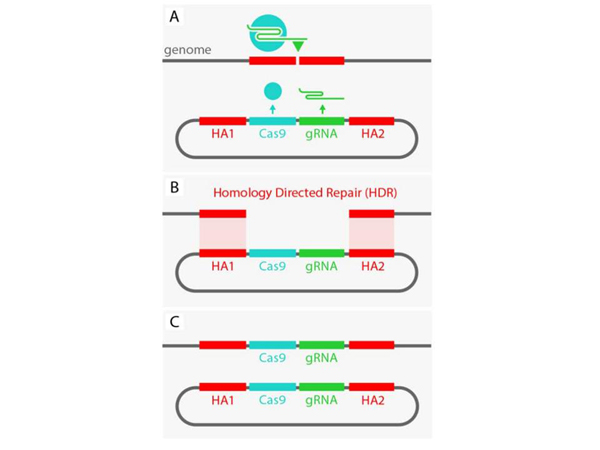
Теперь у нас в клетку еще внедряется некая конструкция, такая круглая штука – плазмида, в которой закодирован в данном случае ген, отвечающий за производство белка «CRISPR/Cas9» и производство «путеводной РНК», которая направляет в место вставки. Но это неважно, мы туда можем вставить и другие гены. Но важно, что эта штука обрамляется двумя последовательностями, они выделены красным. Особенность каждой последовательности в том, что они комплементарны, то есть, образуют такие же «зубчики», скажем так, с фрагментами, которые по бокам от места вставки. И что происходит?
Клетка думает: «Ага, у меня образовалась «дырка» в геноме, как мы будем это исправлять?» Можно просто сшить, но, может быть, у нас было что-то вырезано? И в норме клетка в таких случаях обращается к запасной хромосоме – как там? Если там есть вставка, то ее можно скопировать и вставить, и дырка залатается правильно. И в ряде случаев так и происходит: клетка сама выстраивает гомологичные последовательности друг напротив друга, и достраивает нужные последовательности.
И, когда китайские ученые сделали свою работу, было очень много шума, был скандал, что два ведущих научных журнала получили статью и отказались ее публиковать. Не потому, что она не понравилась им с научной точки зрения, а потому, что они решили, что она может быть этически неправильной. Тем не менее, другой журнал статью опубликовал.
Одна из вещей, про которые писали китайские ученые, была в том, что механизм, который они использовали, еще очень ненадежен. Очень часто происходят ошибки – он создает дырки там, где не нужно. Поэтому для генной инженерии растений и животных это все замечательно, потому что всегда можно отобрать организм, где вставка или разрез произошли там, где нужно, но для человека эту технологию использовать еще рано, потому что вы можете случайно получить «мутантного» ребенка, у которого будут проблемы.
Поэтому, давайте, мы будем пока это делать на нежизнеспособных эмбрионах. С тех пор наука очень сильно шагнула вперед. Я про это еще не успел написать в книжке – когда они получили мутантный вариант белка Cas9, настолько специфичный, что он практически уже не совершает ошибок. По крайней мере, так утверждают авторы работы. Конечно, бывали случаи, когда авторы работ ошибались, но эта статья опубликована в крутом журнале «Nature».
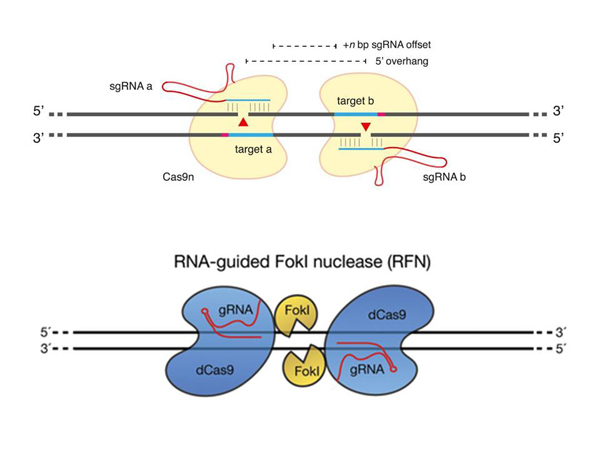
Параллельно с этим появились некоторые очень «крутые» технологии, тоже позволяющие увеличить специфичность этой системы «CRISPR/Cas9». Одна из вещей, которая была придумана, связана с мутантным вариантом белка Cas9. Вот этот белок. Его мутировали таким образом, чтобы он больше не умел делать разрез одновременно в двух цепочках ДНК, только в одной.
В этом случае, если у вас распознается один участок ДНК, в одной цепочке, то у вас возникает одноцепочечный разрез, и для клетки это ерунда, она восстанавливает это без проблем. Только двухцепочечный разрез представляет для нее некоторую заминку – как его нужно обратно сшивать? Поэтому берут две «путеводные РНК», два разных участка, которые находятся рядом в молекуле ДНК, которую вы хотите «целить», одна здесь, другая – здесь, и только в том случае, если у вас два белка Cas9, независимо, распознает два соседних участка, возникает разрез в одной цепи и в другой цепи, только в этом случае происходит полноценный разрез, и происходит необходимая дальнейшая вставка и так далее.
Другая штука, которая была придумана – еще круче. Они догадались, что к белку Cas9 можно приделать еще один белок, который тоже умеет разрезать ДНК. При этом самому белку Cas9 способность разрезать ДНК отменили с помощью мутаций. То есть, вот этот Cas9 теперь только распознает ДНК, определенную последовательность ДНК, которую нужно разрезать, но сам ее не режет.
И в данном случае разрез происходит только в случае, если один Cas9 «сел», «узнал» место, другой Cas9 «сел», «узнал» некоторое место, здесь оказались определенные расстояния, чтобы две половинки белка, который к ним приделали, образовали комплекс, и этот комплекс уже может разрезать эту ДНК, только, если там есть определенное место, которое этот белок сам может разрезать.
То есть, накладывается уже такое количество условий для разрезания, что случайно это произойти не может. Таким образом, можно сильно повысить точность этого метода.
Имея «под рукой» все эти технологии, мы приближаемся к некоему будущему, как в игре, где вкалывают себе плазмиды и приобретают сверх способности. Способностей поджигать предметы пока не получается, но вот суперсила с помощью генной инженерии уже достигается.
Правда, это не связано с CRISPR/Cas9, а с более старыми технологиями, но это неважно. Вот эти грызуны имеют мутацию – у них испорчен белок, который ограничивает мышечную массу. Вот они – накачанные, супер-сильные.
Но то, что сделали в лаборатории, еще 100 лет назад сделала природа – видите этих быков? Их вывели селекционеры в середине XIX века, порода называется Бельгийская синяя. Они совершенно натуральные. На самом деле то, что делает генная инженерия и то, что происходит в природе, очень похоже, отличается только тем, что в природе происходят мутации всякого рода, а нам нужны мутации определенные, которые позволяют нам чего-то добиться.
В этой работе грызунов сделали в два раза больше, но появилось негативное последствие – волосы, которые растут не там, где нужно. Технология пока что не доработана, но мы к этому стремимся. Например, есть биотехнологические методы генной терапии для взрослых, позволяющие побороть импотенцию – и у грызунов и у людей.
Возвращаясь к картинке с плазмидами, где их вкалывали взрослому человеку – возникает вопрос: как мы будем генетически модифицировать человека?
Конечно, мы можем генетически модифицировать эмбрион, из которого получится «ГМО-человек». Но на эмбрионах мы пока не экспериментируем, хотим пока сделать на взрослых людях что-нибудь хорошее.
Изменить каждую из триллионов клеток, существующих у человека, нельзя. Но это и не нужно делать. Очень часто бывают заболевания, связанные с изменением какого-то гена, который должен работать в конкретном типе клеток, в конкретных условиях – например, в клетках печени. Например, гемофилия – при этом заболевании плохо сворачивается кровь. Из-за незначительных повреждений идет сильное кровотечение или появляются сильные гематомы.
Гемофилия связана с мутацией одного из факторов свертывания крови, который производится клетками печени. Соответственно, нам нужно изменить не клетки глаза, не клетки мозга, не клетки кожи, а именно клетки печени. Для этого нужна технология, которая сможет доставить некий правильный вариант гена, отвечающего за фактор свертывания крови, в клетки печени, и нужен механизм, который заставит этот ген там работать.
Здесь один из ключевых моментов – механизм доставки. Для этого можно использовать разные вирусы.
Здесь, правда, показан вирус ВИЧ – в связи с тем, что это вирус, который умеет искать наши клетки иммунной системы, так устроена его оболочка. По аналогии с ним – другие вирусы умеют искать определенные типы клеток. Есть аденовирусы, которые умеют искать клетки печени. Есть вирусы, которые предпочитают клетки нервной системы. Есть вирусы, которые предпочитают клетки слизистой. И так далее.
То есть, вы берете вирус, который ищет определенные клетки, убираете из него все, что делает его вирусом, заимствуете только его оболочку. И в нее засовываете тот ген, который нужно, чтобы был доставлен. Так и было сделано, чтобы помочь людям, страдающим гемофилией. И уже сейчас вариант лекарства от гемофилии клинически проверен. Это уже вариант некоего решения, которое еще не вышло на рынок, но уже тестируется на людях с определенным успехом.
Я говорил про аденовирусы – они хороши тем, что впрыскивают свою ДНК в ядро клетки, и ДНК не встраивается никуда обычно, просто работает. Почему хорошо, что она не встраивается? Мы не хотим встраивать, чтобы что-нибудь не испортить – если во взрослом организме что-то испортить в ДНК, это может привезти к раку. Тут такой риск снижается. Так вот, аденовирус – один из вариантов того, что можно использовать в определенных условиях.
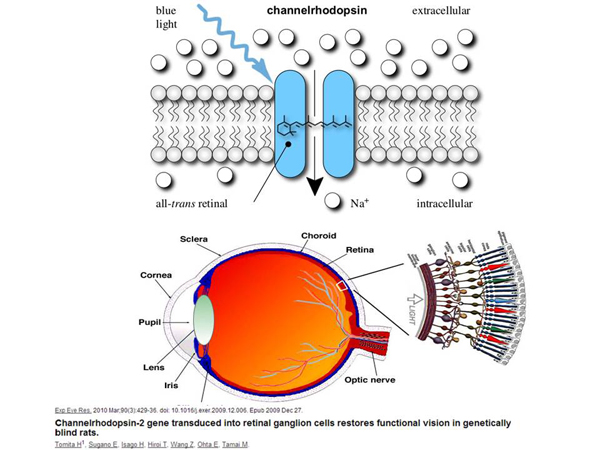
Как я уже говорил, возникает задача – найти такие гены, которые было бы хорошо встроить. Один из самых «классных» генов, которые можно куда-нибудь встраивать и с помощью него создать много разных технологий – это белок каналородопсин, ген этого белка. Это белок, который в природе в норме существует у водорослей. Он находится в мембране водоросли. Когда в этот белок попадает синий свет, он, будучи каналом, открывается и начинает пропускать сквозь себя ионы натрия, положительно заряженные.
Для водоросли это – сигнал, что «вот там светят», и они могут как-то изменить свое положение в пространстве, чтобы более эффективно синтезировать. Но мы можем взять ген этого флуоресцентного белка и куда-нибудь его встроить. Если мы встроим его в нервную клетку животного, то, из-за того, что происходит вброс ионов натрия внутрь клетки, меняется мембранный потенциал этой клетки.
Если бы она была нервной клеткой, она создала бы при этом нервный импульс, который передался бы другим нервным клеткам. То есть, мы могли бы получить нервную клетку, регулируемую светом! Мы светим на нервную клетку, и она активируется. Мы можем управлять нервной системой с помощью света, практически не инвазивно. На основании этого возникла целая наука – оптогенетика, которая сейчас использует такой подход для изучения работы мозга грызунов и подходит к человеку.
Что еще можно сделать с помощью этой технологии и каналом родопсина? Здесь показана структура глаза.
В глазу есть сетчатка, где находятся светочувствительные клетки, реагирующие на свет – есть колбочки, есть палочки. Колбочки реагируют на зеленый, синий и красный, а палочки реагируют на свет или тьму, светло или темно. Бывают заболевания, при которых клетки сетчатки погибают. И мы можем – это было сделано на крысах – заставить эту крысу видеть другими клетками, которые в норме видеть не должны.
Здесь показаны ганглиозные клетки, которые в норме не обладают светочувствительностью. Они как бы собирают сигнал, но сами не активируются на свет. Но мы можем внести в них ген канала родопсина, и они будут возбуждаться на синий цвет. И теперь они сами активируются на свет, подают сигнал в мозг, и мозг эту информацию как-то интерпретирует, потому что оказывается, что эти грызуны лучше ориентируются в пространстве, чем те грызуны, которых не подвергали генной терапии. Возникает механизм, при котором мы можем очень необычным образом лечить разные варианты слепоты. Есть другие заболевания, которые тоже можно так лечить, просто там не так интересно с точки зрения механизма.
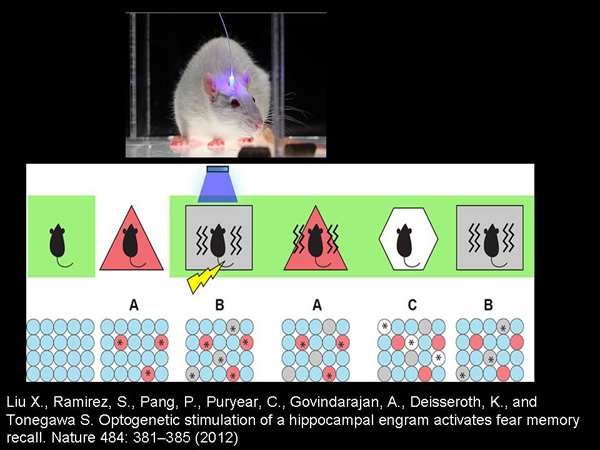
Одна из самых «крутых» работ с использованием оптогенетики – исследование Сусумо Тонегавы, который показал, что с помощью оптогенетического подхода можно «редактировать» память грызунов. Что было сделано? Грызунов помещают в какую-то комнату. Это специальные «генетически модифицированные» грызуны, нервные клетки которых, если они активны, производят белки канала родопсина и становятся свето-активируемыми.
И этих грызунов помещают в некоторую комнату, где у них нервные клетки, связанные с распознаванием и запоминания пространства, начинают вырабатывать белки канала родопсина. После этого грызунов помещают в другую комнату, где их начинают бить током и светить в мозг, чтобы снова активировать те клетки, которые были активны в той комнате, где их током еще не били.
И после этого грызуны начинают бояться той комнаты, где их током не били – только потому, что активированы светом те клетки, которые были активны, когда они были в той комнате. Не очень понятно, как это нужно описывать терминами нашего восприятия, но факт в том, что они начинают бояться той комнаты, где с ними ничего плохого не делали. Это исследование замечательно тем, что показывает: память – не свойство вечной души, а материальная вещь, которую мы можем взять и исправить, изменить. Пусть пока и очень грубо и только на грызунах.
Возвращаясь к теме «других 50 оттенков» – эти грызуны особенны тем, что им внесли специальный ген, тоже связанный с опто-генетикой – эрективный опто-генетический стимулятор, или «Эрос».
Когда их освещают синим светом, у них возникает эрекция – запускается механизм, подобный механизму действия «Виагры». Соответственно, можно себе представить в будущем, что девушка можно подарить синий фонарик возлюбленному – и многие проблемы будут решены. Но можно пойти дальше.
Была оптогенетика, а есть еще термогенетика. Так же, как белок канала родопсин пропускает ионы натрия в ответ на свет, есть белки, которые пропускают ионы натрия и другие ионы в ответ на температуру. На высокую температуру, на низкую температуру. Они в природе есть очень разные. Соответственно, вы можете взять и сделать разные клетки – как нервные клетки активировать температурой, так и другие клетки, активированные температурой.
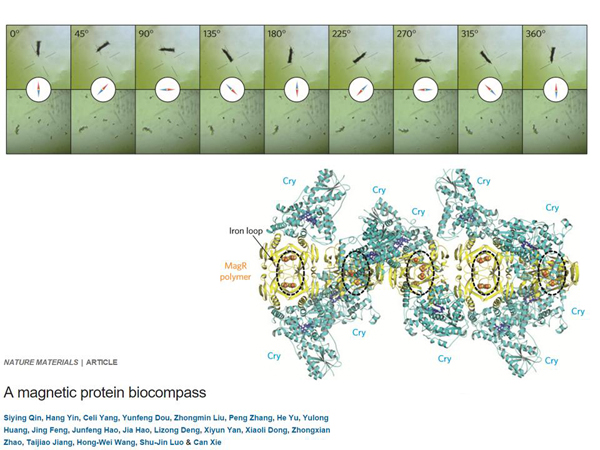
Понятно, что использовать это в тех же самых назначениях, что и «Эрос» будет проблематично, поэтому можно пойти дальше – магнитная генетика. Известно, что у некоторых организмов есть магнитная рецепция, например, у птиц, которые используют магнитное поле для ориентации в пространстве. Мы не знаем, есть ли у людей магнитная рецепция, но у людей есть белок, которые ею обладает. Может быть, это – побочный эффект эволюции. Неизвестно, как мы его используем и используем ли вообще, но вот на этой картинке показаны агрегаты этого белка – это не один белок, это куча белка.
И вы видите, как он выравнивается по стрелке магнитного компаса. Он обладает магнитной рецепцией. Он может связывать кусочки железа и тем самым – ориентироваться в пространстве.
Чем замечательна магнитная генетика? Мы пока что не умеем сделать так, чтобы в ответ на изменение магнитного поля что-то изменилось в клетке, но, если мы научимся это делать, то мы сможем локально что-то концентрировать. Можно будет создавать не инвазивные методы активации каких-нибудь клеток в ответ на изменение магнитного поля в будущем.
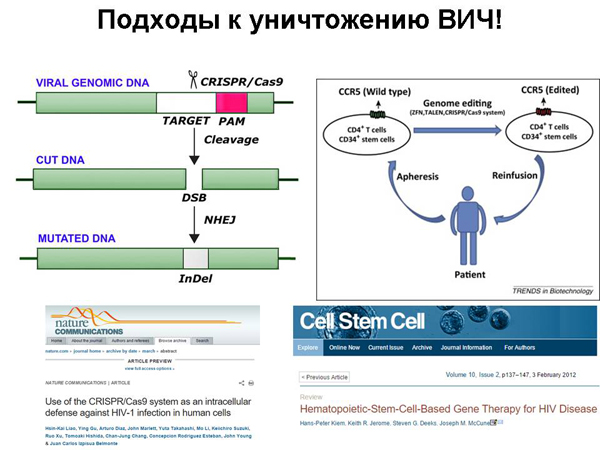
Теперь еще про заболевания. Ученые уже достигли умения лечить ВИЧ и некоторые виды рака. Сейчас расскажу, чего мы достигли. Одна из проблем борьбы с ВИЧ заключается в том, что он умеет внедрять свою наследственную информацию в наши клетки, в клетки иммунной системы, и там может длительное время дремать. И вроде бы вирус победили, а потом – нет, есть зараженные клетки, они начинают производить вирус. И что с этим делать – не понятно.
Оказалось, что мы можем научиться вырезать вирус ВИЧ из ДНК человека с помощью технологии CRISPR/Cas9. Мы можем подобрать направляющую РНК для CRISPR/Cas9 так, чтобы она соответствовала встроенной ДНК вируса иммунодефицита. У самого вируса геном из РНК, но, когда он встраивается в наши клетки, там уже ДНК. И, соответственно, CRISPR/Cas9 может его разрезать. И мы можем, во-первых, делать клетки, устойчивые к ВИЧ, потому что в них есть система CRISPR/Cas9, которая, в случае встраивания «врага», его тут же вырезает, или же мы можем освобождать клетки от ВИЧ, если мы туда доставим CRISPR/Cas9.
Пока что это было сделано только на клетках в культуре: в пробирке получили клетки, зараженные ВИЧ, внедрили в них CRISPR/Cas9, и он там этот ВИЧ повырезал. Возникает проблема, как это исправить в большом количестве клеток в организме, но этот технологический вопрос в будущем попытаются решить и когда-нибудь решат.
Другая вещь, которую можно сделать против ВИЧ – создание генетически модифицированных клеток человека, устойчивых к ВИЧ. Расскажу одну замечательную историю. Уникальный случай был в Германии: человек, болевший одновременно двумя заболеваниями – ВИЧ и лейкемией. Когда у человека лейкемия, его лечат специальной химио- и радиотерапией, чтобы убить активно делящиеся клетки, в том числе и раковые. Но, к сожалению, при этом убиваются и стволовые клетки, дающие начало другим клеткам, например, клеткам крови.
Человеку после этого очень плохо, ему требуется пересадка костного мозга, чтобы возобновить эти клетки. В данном случае решили использовать не простого донора костного мозга, а донора с определенной мутацией. Дело в том, что ВИЧ проникает в клетки иммунной системы, он их узнает – у них на поверхности, кроме других белков, есть специальный белок CCR5. Если этот белок испорчен – а есть люди, у которых он испорчен – то ВИЧ проникнуть в эту клетку не может.
И в природе есть люди, устойчивые к ВИЧ. И в данном случае нашли такого донора, у которого есть эта мутация – с устойчивыми к ВИЧ клетками. Больному пересадили костный мозг этого донора, и с тех пор у этого больного не обнаруживают ни ВИЧ, ни лейкемии.
Но проблема использования такого подхода заключается в том, что химио- и радиотерапии с пересадкой костного мозга – очень опасные процедуры, если человек болен ВИЧ и принимает против него препараты, то ожидаемое время его жизни может быть 30-40 лет. Благодаря хорошим противовирусным препаратам. Если он делает такую операцию, то у него есть достаточно высокий шанс умереть прямо во время операции. Но, с другой стороны, такое решение избавляет от ВИЧ, по-видимому, навсегда.
Так что же мы можем сделать с помощью технологии генной инженерии? Мы можем взять человека, взять клетки его иммунной системы, немного их «подпортить», чтобы они были устойчивы к ВИЧ, и тогда этот человек будет иметь популяцию клеток иммунной системы, устойчивую к ВИЧ и не потеряет весь свой иммунитет.
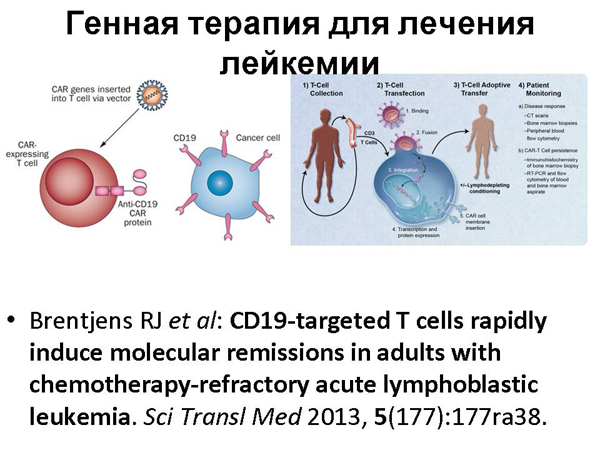
Рак. Раковые клетки – это клетки, которые «сошли с ума», по сути. Из-за мутации они начинают бесконечно делиться, из-за чего возникает раковая опухоль. Наша иммунная система постоянно пытается бороться с раковыми клетками – она пытается найти такую мутировавшую клетку и ее уничтожить. Но иногда пропускает такую. Но иногда мы знаем, какая должна быть молекула, распознающая данный тип раковой клетки, чтобы с ней бороться. Потому что уже есть огромные данные о разных типах раковых клеток и вообще, есть наука, которая описывает, какие иммунные клетки с какими борются.
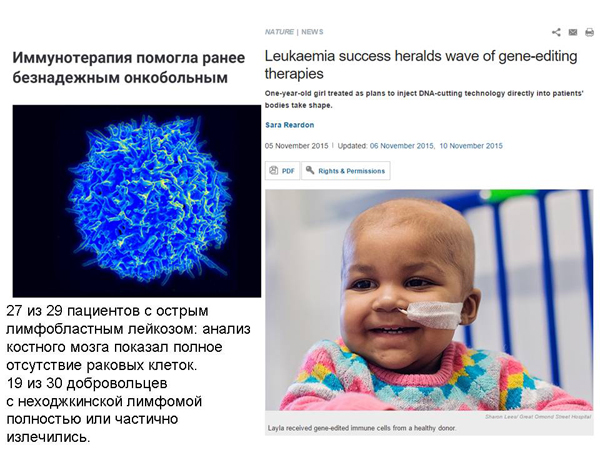
Мы можем взять у пациента клетки его иммунной системы и сравнить их рецепторами, молекулами, которыми они распознают данный тип рака. Это помогает не во всех случаях рака, но помогает. Несколько человек таким образом вылечили, правда, в сочетании с химиотерапией, но все же. И была история про девочку, которую вылечили от лейкемии.
Когда мы говорим про модифицированные иммунные клетки человека – это, практически, ваша индивидуальная медицина. Это очень дорого. Ваши собственные клетки ученые модифицируют, в лаборатории, это никогда не может стать промышленным, массовым явлением. А хотелось бы, чтобы появилось лекарство от рака, которое можно купить, грубо говоря, в аптеке.
И возникла идея: сделать такие «универсальные» иммунные клетки, которые не распознаются иммунной системой и поэтому их можно давать разным людям, и они содержат необходимую защиту и от химио- и от радио-терапии, чтобы сочетать с химио- и радио-терапией, и при этом чтобы они могли распознавать раковые клетки и с ними бороться. И вот эти идеи проверили на этой девочке. Понятно, что клинические испытания должны быть больше, чем один раз, но, по-моему, все это очень воодушевляет.
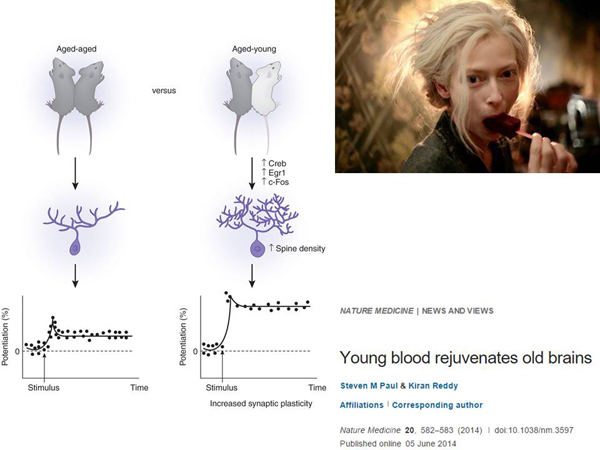
И последнее – продление жизни. В сказке девушка-вампир омолаживалась тем, что пила кровь людей. Но в жизни всё не так просто, как в сказке. Есть такая штука, называется парабиоз. Берут двух грызунов и объединяют их кровеносные системы. При этом старый грызун живет больше, а молодой – меньше. При парабиозе возникает эффект омоложения нервной системы, что было неожиданно для ученых. У нервных клеток частично возникает пластичность – это когда у нервных клеток возникает способность образовывать новые контакты с другими клетками.
И вот пластичность частично восстанавливается, и регенерация мышечных тканей улучшается при парабиозе. Понятно, что никто не предлагает сшивать людей друг с другом. Но, если это работает, из этого следует, что в крови молодого животного есть какие-то факторы – клетки, вещества. И, если мы найдем то, что связано с омолаживающим эффектом, из этого в будущем можно сделать какой-то препарат.
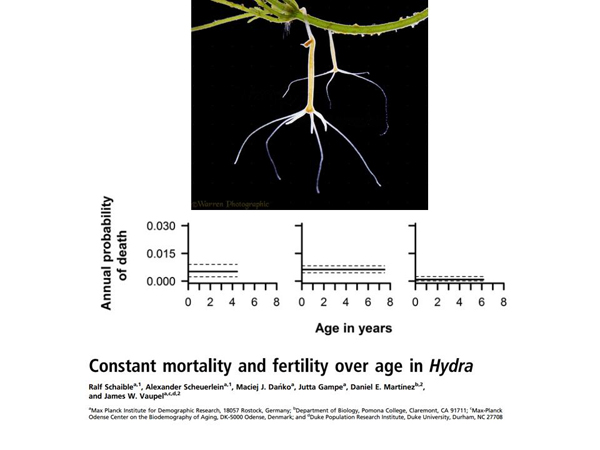
Другая вещь касается принципиального достижения такой вещи, как пренебрежимое старение (negligible senescence). Для нас, для людей, вероятность умереть, растет с каждым годом нашей жизни. Вероятность умереть в 30 лет существенно ниже, чем вероятность умереть в 50. Это гидры, у которых вероятность смерти с возрастом не меняется. Этих гидр нашли где-то в природе и посадили в некий индивидуальный инкубатор с комфортными условиями, где у них нет угроз для жизни, они там живут и с возрастом «не портятся».
Ну, это гидры – далекие от нас организмы. А поближе?
Например, вот этот голый землекоп. В норме грызуны живут два года. А эти ребята живут 25 лет. Этот вопрос ученых очень сильно интересует – почему же они живут так долго? А еще они очень нечасто болеют раком, раньше считалось, что они вообще не болеют. Почему? По-видимому, потому, что у них есть дополнительный механизм, позволяющий контролировать рост опухоли – клетки перестают расти, если их становится слишком много.
Сейчас этих землекопов активно изучают, чтобы понять, как они добились такой долгой жизни, чтобы потом применить это и для нас. Но факт, что для млекопитающего обнаружено явление пренебрежимого старения. Это не бессмертие, а то, что с возрастом хуже не становится.
И закончить лекцию я хотел бы картиной «Триумф смерти». Во всем мире, не только в нашей стране, тратится огромное количество денег на разную ерунду – на военный бюджет, на самую большую яхту, у кого самая большая яхта, самые дорогие часы… Понятно, что через какое-то время – лет через 500 - мы достигнем технологии пренебрежимого старения, научимся генетически модифицировать людей, делать их лучше, причем при жизни, и наступит некое светлое будущее.
Вопрос в том, доживем ли мы до него. Ладно, не мы, значит, наши дети и внуки – доживут ли до этого светлого будущего. И это зависит от того, как мы будем относиться к науке, как мы будем ею заниматься, и какую роль наука будет играть в нашей экономике в нашей стране и вообще – в мире. Вот поэтому мне кажется таким важным популяризовать науку и бороться за то, чтобы наука развивалась, и всякие препоны в колеса научно-технического прогресса не ставились. Это одна из тех вещей, которые мотивировали меня на написание моей книги.
Перед тем, как мы перейдем к вопросам, я упомяну про фонд «Эволюция», который пытается развивать идею популяризации науки переводом книг с английского на русский, есть сайт, можете туда зайти и посмотреть. И теперь переходим к вопросам, за самый хороший вопрос я подарю экземпляр своей книги. (Аплодисменты).
Обсуждение лекции
Борис Долгин: Спасибо большое. Переходим к вопросам, и по традиции я начну со своего. Там, где была упомянута память, почему это интерпретируется как память, а не как нормальный условный рефлекс?
Александр Панчин: Этого грызуна в этой комнате током не били – на что у него должен был возникнуть условный рефлекс?
Борис Долгин: На тот фактор, который у него вызывает панику.
Александр Панчин: А какой фактор вызывает у него панику?
Борис Долгин: Свет.
Александр Панчин: Но в той комнате его не светили.
Борис Долгин: А неважно, где. Если представить себе классический эксперимент Павлова с переносом в другой помещение, то это нужно было бы интерпретировать как реакцию на вмешательство в память?
Александр Панчин: Нет. Там есть весь нужный контроль. Вы можете занести эту мышку в комнату, где ее не светили и током не били.
Борис Долгин: Но на свет будет реагировать.
Александр Панчин: Она боится не комнаты, где ее светят. В той комнате ее никакому свету не подвергают. Ее вносят в другую комнату, где ей светят в мозг и бьют током, но боится она не света, а комнаты. Не света, а комнаты, в которой ее ничему не подвергали. Она в этой комнате просто была. На самом деле, я немного упростил описание эксперимента.
Борис Долгин: Меня интересует, как доказывается, что она боится не света, а комнаты?
Александр Панчин: В том месте, которого она боится, света нет.
Борис Долгин: Еще раз: боязнь после чего возникает?
Александр Панчин: Боязнь возникает после того, как в другой комнате ей одновременно дали в мозг ток и свет.
Борис Долгин: Как проверяется боязнь первой комнаты?
Александр Панчин: Её сажают в комнату и смотрят, как она там себя ведет. Но не светят.
Вопрос: Вопрос о пятидесяти оттенках биотехнологий. Собственно, это принципиально большая разница и ценность – какую технологию мы развиваем: увеличение длины полового члена или остаемся мы в живых, или нет. В конце лекции есть такое, что «ну, мы не доживем». Собственно, так и в книге – «я думаю, что, наверное, мы не успеем». А потом – 20 страниц текста о том, как это нужно сделать. Весь комплекс программы борьбы со старением. Тем не менее – почему все время такая оговорка «мы не успеем»? Надо же призвать общество к тому, что есть шанс успеть!
Александр Панчин: Всё очень правильно сейчас сказано. Когда я пишу книжку, я пытаюсь быть максимально честным. Это есть моя оценка – я не исключаю, что мы можем дожить до этих технологий. Было бы здорово, если бы мы дожили. Вопрос в том: насколько интенсивно мы будем этим заниматься? Я не готов пообещать присутствующим здесь, что все доживут. Я говорю, что мы, МОЖЕТ БЫТЬ, доживем. Чтобы увеличить шансы на «доживание», к этому надо приложить определенные усилия. Но я не готов обещать, что так получится. Я бы хотел до этого дожить, но я не могу этого обещать.
Борис Долгин: Если я правильно понимаю смысл вопроса, один из его оттенков был в том – не имеет ли смысл спроектировать исследования так, чтобы впереди было то, что обеспечивает доживание и так далее. Это про это вопрос?
Вопрос (продолжение): Это комплексный вопрос. Скорее про позицию: Александр говорит, что «стакан наполовину пуст», а я предлагаю ему говорить, что «стакан наполовину полон».
Александр Панчин: Я очень хорошо отношусь к людям, которые говорят, что «стакан наполовину полон», и я всячески рад, что такие люди есть, они вносят существенный вклад в движение прогресса. Но я просто пытаюсь продемонстрировать определенный уровень честности.
Борис Долгин: То есть, корректно обозначается: что уже есть, что будет завтра, а что в принципе может быть, но точных дат назвать нельзя?
Александр Панчин: Да. Так.
Вопрос: Александр, понравилось слово, которое вы произнесли: «честность». Скажите, ищут ли ученые ген честности? (Смех в зале).
Александр Панчин: Надо понимать, что, когда говорят ген чего-нибудь, это чаще всего сильно упрощено. Гены обычно не «чего-нибудь», а они много, чего делают. По поводу честности. Не знаю исследований конкретно про честность, но по аналогии: когда ищут генетическую компоненту к склонности к насилию, например. Берут людей, у которых есть история насилия и берут тех, у кого такой склонности нет.
Берут их очень много и смотрят, есть ли варианты генов, которые вовлечены в работу нервной системы, например, которые были бы перепредставлены у тех людей, которые определенным поведением отличаются. Некоторые варианты этих генов находят, и журналисты быстро объявляют их генами чего-нибудь, например, «ген насилия». Это говорит, что некоторые особенности нашего поведения определяются генами. Нельзя сказать, что какой-то один ген за это отвечает, но совокупность генов и некоторые варианты и их взаимодействие друг с другом связаны с той или иной формой поведения.
Вопрос: У меня вопрос про ГМО: во всем мире сейчас ведется мощная полемика, и до сих пор есть два лагеря. Одни говорят, что это очень вредно, другие говорят, что это не влияет на качество нашей жизни. Что ученые говорят по этому поводу?
Александр Панчин: Тема ГМО – это тема, по которой общество – ученые, специалисты и обыватели – максимально разрознены в своих оценках. Есть ассоциация ученых AAAS, самая крупная ассоциация ученых в мире, издающая журнал «Science». Их опросили и 88% сказали, что ГМО в продуктах безопасны. Это ученые разных профилей. Понятно, что, если вы опросите молекулярных биологов, там будет вообще 90%. В России 80% населения считают, что ГМО вредны и их нужно запретить, в Америке около 70% населения считают, что ГМО вредны. Почему люди боятся ГМО?
Вопрос (продолжение): Они считают, что ГМО повлияют на качество жизни.
Александр Панчин: Они просто немного не понимают, что это такое. Был проведен опрос в США: нужно ли маркировать продукты, содержащие ГМО? 82% ответили, что маркировать нужно. В том же самом опроснике на вопрос «Нужно ли маркировать продукты, содержащие ДНК?» 80% ответили, что маркировать нужно. Если вы спросите, как расшифровывается ГМО, то вам мало, кто ответит.
Вопрос (продолжение): У меня вопрос про новомодный белок CRISPR/Cas9: как ученые его программируют, что он разрезает молекулу именно в нужном нам месте, и как он так не делает ошибок, чтобы не повредить организму?
Александр Панчин: CRISPR/Cas9 воздействует на ту последовательность ДНК, которая комплиментарна путеводной РКН. Вот эта РНК, которая нужна для работы белка CRISPR/Cas9, состоит из двух частей: есть некоторая часть универсальная и нужна для того, чтобы CRISPR/Cas9 «понял», что это – та путеводная РНК, которая ему нужна, чтобы что-нибудь искать с помощью нее. Он не будет брать любую РНК и ее использовать.
А вторая часть – та, которая, собственно, направляет, она должна быть комплементарна (взаимодополнительна) некоторому участку, который вы хотите разрезать. Мы создаем эту РНК, мы ее синтезируем. Вы можете сделать ген, который будет ее в клетке сам производить. В клетку встраиваете ген, который будет синтезировать РНК и другой ген, который нужен для синтеза Cas9. Тогда в клетке образуется белок и «правильная» путеводная РНК. И тогда этот белок берет эту «правильную» путеводную РНК и с помощью нее ищет то, что вот так комплементарно .
Вопрос (продолжение): Еще у меня есть даже не вопрос, а пожелание, которое почему-то задвигается учеными на задний план, хотя, мне кажется, оно перспективно – я насчет старения: надо изучать людей, которые дожили до 100-120 лет, до 140… Надо изучать их геном…
Александр Панчин: До 140 – таких нет. Изучают геном, изучают. Максимальный возраст – 122 года. Рекорд долгожительства. На самом деле, изучают – что может быть связано со сверх долголетием. Пока нет ничего такого, чем можно было похвастаться. Есть еще проблема – поскольку людей много, то может быть, что часть доживших до сверхдолгого возраста – случайная флуктуация. Грубо говоря, что большинство людей умирают, ну а некоторым повезло. Наследственные компоненты, конечно, есть. Но понять, почему долгожители так долго живут – конечно, тяжело. Но исследования ведутся.
Вопрос: У меня вопрос к вам, как к популяризатору науки: не думаете ли Вы, что достижение бессмертия демотивирует человека к развитию? Спешить-то некуда.
Александр Панчин: Мне кажется, наоборот – мотивирует. Моя личная философская позиция такая, что, как раз, наоборот – смертность достаточно сильно обесценивает развитие: живешь-живешь, делаешь что-то, а потом раз – и умер. Понятно, что, когда не боишься умереть раньше времени, мышление меняется, но я не думаю, что это демотивирует. Меня бы это точно не демотивировало.
Вопрос: Скажите, я так понимаю: CRISPR/Cas9 – это новая технология разрезания в нужном месте? Тогда как до этой технологии встраивали? Беспорядочно?
Александр Панчин: На самом деле, жизнь так устроена, что организмы любят в себя что-нибудь встраивать. Те же бактерии могут взять кусочек ДНК из окружающей (среды) и в себя встроить. Когда речь шла про генно-модифицированные растения, то использовали такие агробактерии, у которых есть механизм переноса и встраивания своей ДНК в ДНК других растительные клетки.
Есть куча белков у них, которые этим занимаются. Была такая технология: брали бактерию и «говорили», что вот теперь, бактерия, ты будешь переносить не свои гены, а наши. И бактерия этим занималась за нас. Есть вирусы, которые встраивать умеют, но они встраивают куда-то. Особенность этой штуки в том, что мы говорим, где надо сделать разрез, чтобы туда с большей вероятностью встроить. Развивают сейчас очень много технологий. Эта самая «попсовая», есть и другие механизмы точного разрезания, другие подходы. Они тоже развиваются, но не такие популярные, потому что не на слуху.
Вопрос (продолжение): И второй вопрос: насчет этической стороны. Когда стоит вопрос о биотехнических разработках механизма против старения на одной чаше весов стоит долгая жизнь, а на другой – проблема перенаселения, ресурсов, и перспектива таких технологий даже пугает. Кто решает?
Александр Панчин: Я плохо себе представляю, кто и как это решает. На самом деле, идея, что борьба со старением приведет к демографическим проблемам, мне кажется немного надуманной – если мы посмотрим, то увидим, что проблемы с перенаселением возникают в странах с плохим уровнем жизни и связано это с тем, что люди по-другому думают.
Если вы предполагаете, что станете старым и немощным, государство платить вам не будет, то ваша единственная надежда на нормальную старость – много детей, с запасом. Потому что часть из них погибнет от малярии, а часть – еще от чего-нибудь. Вы можете надеяться, что кто-нибудь из них не окажется гадом и будет кормить вас и беречь. Эта идея есть в культуре многих стран.
А когда вы добиваетесь высокого научно-технического прогресса, когда у вас люди редко умирают, когда у вас высокая производительность труда, и один человек может прокормить сотню, эффективно устроено сельское хозяйство, то у вас все меняется. Вам уже не нужно переживать, что у вас не будет потомков, которые о вас будут заботиться. И мы видим, что в самых развитых странах возникает демографический спад. Он является признаком того, что у вас все хорошо.
Борис Долгин: Я должен заметить еще одну вещь: пока что история показывает, что попытки остановить те или иные технологии оказываются тупиковыми. Можно остановить в одном месте, технологии «вылезут» в другом. Их можно только чуть притормозить. Но в целом ситуацию это не изменит.
Александр Панчин: Дополню. Представьте себе, что все сказали, что не будут делать генно-модифицированные эмбрионы, а Китай сказал, что будет. И любой человек, у которого есть достаточно денег, просто поедет в Китай и использует там эту технологию. И в итоге Китай развивается, а остальные страны начинают хвататься за голову и говорить, что отстали от научно-технического прогресса.
Вопрос: Не совсем понятен пример землекопа. Он что, не стареет?
Борис Долгин: Я объясню вопрос: почему в качестве примера необычного долгожительства вы привели именно голого землекопа, если есть организмы, живущие значительно дольше 25 лет?
Александр Панчин: Я понял. Он приводится в качестве примера потому, что является аномально долгоживущим организмом для млекопитающего такого размера. Дерево в этом смысле не очень интересно, оно отличается от нас миллионами показателей, и сделать человека более похожим на дерево – путь не очень конструктивный. А тут мы видим, что есть один грызун и другой, крыса и землекоп, очень похожие друг на друга.
Но почему-то землекоп живет значительно дольше – значит, у него за достаточно недавнее время возник какой-то механизм, помогающий ему так долго жить. И, если мы этот механизм найдем, у нас есть более высокий шанс применить его к другим млекопитающим, в частности – к нам. А дерево, конечно, живет долго, но к нам применимо не очень. А бактерии – они, конечно, делятся пополам, но тоже нам не помогает.
Борис Долгин: Иными словами, если бы нашелся вид более близкий человеку, более недавно по времени отошедший от этой ветки, но обладающий необычным долгожительством, то исследовали бы его? А так самым близким долгожителем является голый землекоп?
Александр Панчин: Да.
Вопрос: В свое время по поводу случайности эволюции Волфганг Паули (Wolfgang Ernst Pauli) придумал такой аргумент: что, если бы эволюция шла случайным образом, изменения шли произвольным образом, то наблюдаемая длина эволюции была бы гораздо дольше.
Борис Долгин: А с чего вдруг?
Вопрос (продолжение): Случайность – она и есть случайность. Пока все варианты переберут…
Борис Долгин: «Пока все варианты переберут» – и дальше?
Вопрос (продолжение): Пока все варианты переберут, выживут они, не выживут, пока они произведут на свет осмысленно потомство… Как если дать обезьяне печатную машинку, то с какой-то вероятностью она напечатает «Войну и мир». То есть, есть ли какие-то механизмы направленной эволюции или чего-то такого, что объясняло бы все это?
Александр Панчин: Я понял вопрос. Пример про печатную машинку очень хорош, чтобы показать неправильные представления о том, как происходит эволюция, которые вообще очень распространены. Идея о том, что мартышка напечатала «Войну и мир» неправильна. На самом деле все происходит не так.
У вас условные мартышки печатают какой-то бессмысленный текст. Но иногда, по каким-то причинам, там получается слово. И слово это лучше бессмыслицы. И фраза, в которой есть слово, например, «Маша», гораздо лучше той, в которой слова «Маша» нет. Мартышки слово «Маша» оставляют и дальше печатают что-то. Вдруг получается «Маша села» или «Маша съела». Это уже лучше, чем просто «Маша». А «Маша съела конфету» еще лучше! И так на каждом этапе возникает что-то, что было лучше предыдущего.
Борис Долгин: Прошу прощения. Это – механизм, который будет поощрять это, и нужен механизм самообучения системы?
Александр Панчин: Да. На эту тему на Youtube есть видео, которое называется «Слепой часовщик». Знаменитое «если вы будете разбитые часы трясти в ящике, то часы не соберутся». Правильно, потому что эволюция касается тех объектов, которые обладают способностью размножаться, у которых есть отбор – некий критерий, когда кто-то выживает, а кто-то не выживает, и есть наследственная информация.
И человек сделал компьютерную симуляцию: часы разбиваются, но дальше начинают действовать эти законы. Часы могут скрещиваться по некоторым правилам, получить потомство, из которого отбирается то, которое будет лучше показывать время. Возникает некая эволюция даже: сначала получаются маятниковые часы, потом – со стрелками, потом – трехстрелочные. В общем, это более правильное представление об эволюции, что и как происходит.
Вопрос (продолжение): В этом случае дальше: что определяет осмысленность?
Александр Панчин: В данном случае – ничто.
Вопрос (продолжение): То есть, внешние условия определяют выживаемость в данной среде?
Александр Панчин: Да.
Вопрос (продолжение): Ну, мы так легко можем к лысенковщине скатиться. Что поставив нужные условия, мы получим нужный результат.
Александр Панчин: А так и происходит! Я рассказывал про ученых, которые получали красные флуоресцентные белки. Они хотели получить красные флуоресцентные белки. Они поставили условия, сказав: «Мутация у нас случайная, но, если в результате мутации белок из зеленого становится чуть более красным, то этих бактерий мы поощряем, размножаем. И в результате путем случайных мутаций и такого отбора у них получились красные флуоресцентные белки. А у нас ученых заменяет среда. Если бы по каким-то причинам в среде получилось бы, что красный белок лучше зеленого, то получился бы красный.
Вопрос: Как я заметил, все эти механизмы в биотехнологии крутятся вокруг одного и того же – молекулярные ножницы, контейнеры, векторы. Вы можете спрогнозировать – что еще в принципе можно делать? С одной стороны – как игрушки, с другой стороны – для пользы. Что касается ГМО – разумеется, они безопасны, но политическая и экономическая ситуации сложились так, что их клонировать сейчас нежелательно. И еще – чем старше человек, тем сложнее заниматься его изучением, его тканей.
Александр Панчин: Вопрос был про то, что еще можно придумать? Если совсем углубиться в фантастику, то мне кажется, что в будущем будут такие маленькие нано-роботы редактировать ДНК, используя какие-то «крутые» механизмы, латать все «дыры» организма, в каждой клеточке.
Я думаю, что обязательно будут использоваться генно-модифицированные клетки самого человека, в очень широком смысле, которые будут пополнять пул наших клеток специальными, более «клёвыми» клетками. Мы не будем модифицировать, например, клетки кожи. А внесем стволовые клетки, которые будут постепенно замещать существующие клетки на новые, модифицированные.
Будут версии человека – «версия 2.0», например. Будут говорить: «О, что-то ты какой вялый! Наверное, еще на версии 3.0 ходишь? Давай, ставь, как я, версию 4.0, будешь быстрее бегать, будешь девушкам больше нравиться!» Будем «апгрейдить» сами себя – вколол себе что-то и побежал. Как у Лемма – когда люди научились себя «пачить», начали возникать разные субкультуры: кто-то считал нужным упрощаться, уменьшать уши, убирать пять пальцев и оставлять только три. А кто-то считал, что нужно усложняться – увеличивать число конечностей, зубов. На эту тему лучше читать фантастов, конечно.
А из того, что делается сейчас: одна из «крутых» вещей – это нано-коробочки. Мы можем делать такие коробочки, внутри которых можно что-то запихнуть, типа тех же генов. И коробочки сами могут состоять из той же ДНК или из чего-нибудь еще, и они будут раскрываться, когда подойдут к нужной клетке и что-то туда впрыскивать. Вот такие сейчас есть «крутые» технологии всякие, они тоже когда-нибудь найдут «крутое» применение.
Вопрос: Вопрос такой: если мы когда-нибудь найдем какой-то эликсир вечной молодости? Что значит «эликсир вечной молодости» – то есть, что-то будет нам делать все больше новых клеток. Но, допустим, его встроили в человека. Ему достался «ген бессмертия» и какие-то мутации, допустим, предрасположенность к раку. Получается, у него делится много клеток и при этом еще существует предрасположенность к раку. Разве это не будет парадоксом?
Борис Долгин: Пожалуй, я расширил бы еще вопрос. По мере того, как увеличивается продолжительность жизни, мы сталкиваемся с теми болезнями, с которыми люди, доживая лет до 30, не сталкивались. Соответственно, возникает необходимость в новой медицине и так далее. Насколько много вы ожидаете новых медицинских проблем после того, как существенно будет меняться продолжительность жизни? Я пока не говорю о вечности. Речь шла об этом? Нет?
Вопрос (продолжение): Я говорю о том, что человек размножается, передает свои гены другим людям, и получается, что ген бессмертия – допустим, он захотел размножиться…
Борис Долгин: А, ваш вопрос всего лишь заключается в том, не будет ли при разработке в средстве, которое будет найдено для такой бесконечной продолжительности жизни, учитываться при его разработке то, что оно может как-то модифицироваться по мере того, как будет идти дальнейшее размножение?
Вопрос (продолжение): Нет, не модифицироваться!
Борис Долгин: Опять не так?
Реплика: Я понимаю вопрос. Автор вопроса еще слегка путается и рассматривает «бессмертного человека» в поколениях – уж бессмертие, так бессмертие. А тут, насколько я понял вопрос, не получается ли противоречие: живет человек, тут у него рак, и он, по идее, должен умереть от рака. Но рак – это только заболевание. И тот же самый голый землекоп не болеет раком. И средство, продляющее жизнь, а тем более – достижения бессмертия, это средство, автоматически предотвращающее онкологические заболевания. В противном случае мы не имеем никакого «эликсира бессмертия».
Александр Панчин: В каком-то смысле – да.
Вопрос: Какой бюджет у биотехнологий? Что можно там удешевить, чтобы технология пришла на достаточно бытовой уровень – в школы, в институты?
Александр Панчин: Смотрите. На самом деле, простые опыты по генной инженерии в западных школах уже делают. Это не очень дорого. Если взять фундаментальную науку, то люди за гранты РФФИ – порядка 500 тысяч рублей в год на лабораторию – умудряются делать исследования по генной инженерии в лабораториях. Кто-то получает растения с геном человека или бактерию с геном человека в лаборатории. Я этим занимался, когда был студентом.
Да, нужно какое-то оборудование. К тому же, это не очень дорого. Что дорого? Что вы что-то сделали, и вам теперь нужно, чтобы, во-первых, это было полезно, а потом – чтобы это было отточено и прошло через все регуляторные инстанции. Если вы хотите сделать, например, генно-модефицированное растение – к примеру, пшеницу, растущую на соленой почве – это не очень сложно и не очень дорого. Но прежде, чем выйти на рынок, вам скажут, что нужно пройти 1500 испытаний, еще что-то…
Вопрос (продолжение): То есть, самое дорогое – это борьба с бюрократией?
Александр Панчин: Если мы говорим про коммерческую реализацию проекта, то это – огромные испытания на безопасность и борьба с бюрократией. Эти вещи немного связаны, потому что сейчас есть мнение, в частности – и мое тоже – что мы чрезмерно обеспокоены безопасностью, когда речь идет про ГМО. И всяких мышек мы травим зря. Мы знаем, что это не должно быть опаснее, чем селекционный сорт, и селекционные сорта растений мы ведь не подвергаем таким проверкам? Каким-то нужно подвергать, ведь все может быть – путем случайных мутаций может получится картошка, богатая соланином. Понятно, что контроль качества продуктов должен быть на уровне государства. Но все испытания на проверку безопасности ГМО-организмов – это то, что мы и так знаем, что нет никакой разницы. И это требует кучи денег.
Борис Долгин: Иными словами, это вопрос нахождения оптимального уровня гарантии безопасности и оптимальной цены?
Александр Панчин: Это вопрос риск-менеджмента. Есть разные оценки рискованности технологии. В зависимости от того, какова ваша оценка риска, вы тратите разное количество средств на проверку – эти риски реализовались или нет. И проблема заключается в том, что сейчас оценка рисков слишком высокая по сравнению с тем, какой она должна быть адекватной. Скорее всего, нужна научная дискуссия об адекватной оценке этих рисков.
Борис Долгин: Ну, да. Но затем выводящаяся в общественное поле, потому что решение принимают везде (общественное).
Вопрос: Ваш прогноз по генной терапии: через какой период времени она войдет в повседневную практику и ею можно будет воспользоваться, например, в клинике в Америке, в России?
Александр Панчин: Я думаю, что это – вопрос десятилетия. Смотрите: уже есть генная терапия, она доступна очень избранным людям. Причем, не то, что очень богатым людям, а тем, кто может лично опасть в список людей, на ком будут проводить испытания, грубо говоря. Но уже есть компании, которые почти вывели продукт на рынок. Стоит он миллион долларов приблизительно.
Вопрос (продолжение): То есть, вопрос в цене?
Александр Панчин: Да, вопрос в цене.
Вопрос: Скажите, ведутся ли разработки по лечению синдрома Дауна с помощью генно-модифицированных клеток?
Александр Панчин: Если честно, я не слышал. Я думаю, что тут больше должна быть профилактика в плане перинатальной диагностики – эффективный способ предотвращения. Но, когда этот синдром уже возник, там уже многое пошло не так. Даже если мы уберем эту «лишнюю» хромосому из всех клеток, то те ткани, которые уже сформировались неправильно, они уже не расформируются, не станут «правильными». Я не думаю, что в ближайшее время появится генная терапия от синдрома Дауна.
Вопрос: Добрый вечер. Вопрос по вирусной доставке генного материала в клетки. Вирус ведь очень мал, десятки или сотни нанометров – как вставлять генный материал в капсид (внешнюю оболочку вируса)?
Александр Панчин: У вируса есть определенный фиксированный размер длины, есть определенные участки, специфичные для данного вируса, которые отвечают за «упаковку» в капсид. И благодаря этому, капсид, который синтезируется внутри клетки, распознает то, что он должен в себя засунуть, засовывает и образуется целая вирусная частица.
Принцип заключается в том, что вы узнаете путем исследования, что именно в вирусной молекуле ДНК или РНК отвечает за «упаковку» в капсид, какие пределы, размеры этой последовательности, дальше вы пытаетесь запихнуть свою генетическую конструкцию, чтобы она удовлетворяла этим размерам и всем этим условиям. И после этого вы где-то в одном месте производите капсид, в другом месте вы производите ваш конструкт.
Отсюда вы берете только белковую фракцию, если капсид белковый, чтобы туда не попала вирусная наследственная информация, оригинальная, которая была у этого вируса. А отсюда вы берете только наследственную информацию, вы смешиваете все это в пробирке и подбираете какие-то определенные условия, чтобы произошла эта «сборка». После этого вы замораживаете, чтобы «конструкция» не сдохла и транспортируете.
Вопрос (продолжение): Как это можно сделать, если вирус с минусовым «п», которому, кроме всего прочего, нужна своя вирусная полимераза?
Александр Панчин: Во-первых, не все вирусы используются. Разные вирусы имеют разное качество для генной терапии. А, во-вторых, какие-то вирусные гены вы можете перенести в некоторых случаях. Если вы захотите использовать, например, ретровирус, то понятно, что вам нужна его обратная транскриптаза, которая встраивает гены в ДНК, потому что вы именно это хотите сделать, но другие гены вы можете испортить, чтобы вирус все-таки не размножался.
Вопрос (продолжение): Вы упоминали какие-то универсальные иммунные клетки, которые можно давать любым людям, и они не будут атакованы уже имеющейся иммунной системой. Каким образом их получают, как разбираются с гисто-совместимостью?
Александр Панчин: Если честно, я боюсь сейчас соврать, всех деталей процесса я не знаю. Они придумали что-то, что позволяет этим клеткам избегать детекции иммунной системы. Как это сделано – я боюсь соврать. Очень хороший вопрос, очень правильный, но это уже узкая область, где я еще не докопался глубоко достаточно.
Вопрос: Вопрос про эволюцию. На основании вашей лекции я понял, что мутация может происходить благодаря бактериям, которые что-то встраивают в ДНК, вирусам, может быть, радиации. Всегда ли эти мутации происходят под воздействием внешних факторов? Обязательно ли условие воздействие внешних факторов?
Александр Панчин: Смотрите. Мутация происходит всегда. Даже сам процесс удвоения молекулы ДНК, когда вы хотите из одной клетки получить две, ДНК сначала должна удвоиться. Даже в этом процессе могут происходить мутации. Фермент, который удваивает молекулу ДНК, он не безупречен, иногда он делает ошибки.
С другой стороны, то, что происходит с этой стороны у бактерий, чем еще эта штука интересна с точки зрения эволюции – по сути, это первый и единственный в мире показанный пример эволюции по Ламарку. Есть эволюция со случайной мутацией и естественным отбором, здесь мутация не случайная, определенный кусочек вируса был встроен куда-то там. И это наследуется.
Это такой любопытный пример, но дальше происходит эволюция по Дарвину, потому что иногда встраивается неправильно, от этого бактерия подыхает. И вообще, многие бактерии не переживают вирусную инфекцию.
Вопрос: Во время лекции вы упомянули о пластичности мозга. Я читал в научной литературе, что есть какой-то белок, который может «отключать» ген. Есть какая-то такая технология?
Александр Панчин: «Выключать» гены достаточно легко. Достаточно забавно, как это описывается: «Что нужно сделать, чтобы выключить ген? Вы должны внести копию этого гена, перевернутую задом наперед». Здесь наверняка может быть забавно – (если) литературную метафору вставить. У нас, эукариотов – растений, грибов, животных – есть такой механизм, называется РНК-интерференция.
Наши клетки не любят двухцепочечную РНК, все наши РНК из одной цепочки. Хотя, в принципе, РНК могла бы быть двухцепочечная, как и ДНК. Потому что очень многие вирусы используют двухцепочечную РНК, как носителя своей наследственной информации. И, когда наша клетка распознает двухцепочечную РНК, она сразу говорит «О, это какая-то гадость!», берет кусочек двухцепочечной РНК, делает из нее одноцепочечную и идет искать все похожие и резать их на части.
И это приводит к эффективному «выключению» любого гена, который похож последовательностью на эту РНК. Поэтому если у вас есть нормальный ген, вы вставили в организм копию этого гена, перевернутую задом наперед, у вас образуется двухцепочечная РНК, и оба этих гена «вырубаются», по сути. Всегда мы знаем, что нужно сделать, чтобы ген выключился.
Вопрос (продолжение): Можно ли таким образом лечить что-то, какие-то заболевания?
Александр Панчин: Есть заболевания, связанные с тем, что какой-то ген слишком активно работает, и мы можем его задавить.
Вопрос: Биотехнологии – это некое производство. Есть ли какой-то план производства? Чем занимаются коммерческие предприятия?
Александр Панчин: Я был только в научных лабораториях, где занимаются производством. На самом деле, это очень похоже. Особенность биопроизводства в том, что вот вы сделали хороший сорт растения в лаборатории, отдали фермеру, у него все взросло. И дальше само размножается. Поэтому производство в этом смысле довольно простое.
Есть отдельная область – биотехнологическое производство лекарств с помощью микроорганизмов, вот там да: есть какой-то бак, реактор, куда сажают генно-модифицированные организмы, их кормят в большом количестве питательными веществами, они что-то там производят, потом оттуда что-то берется, очищается и получается какой-то готовый препарат и так далее. Но, когда речь идет о создании генно-модифицированных организмов, то тут как в селекции – вы сделали, получили новый сорт и дальше его размножаете.
Вопрос (продолжение): Но стоимость реактивов? Например, CRISPR/Cas9 сколько может стоить?
Александр Панчин: В зависимости от того, что вы хотите сделать. Вопрос очень сложный. Если вы уже знаете, какую именно мутацию и где именно вы хотите сделать, в организме, который является модельным – люди уже умеют его выращивать, умеют с ним работать. Если вы просите генно-модифицировать, к примеру, панду, которая не хочет размножаться в неволе, то у вас будут проблемы. Но если вы хотите генно-модифицировать табак, который в любой лаборатории физиологии растений может быть использован, как модельный организм, то тогда у вас все легко и дешево. Потому что уже есть люди, которые умеют это выращивать. Все упирается в такие вот детали.
Борис Долгин: Если я правильно понимаю, вас заинтересовала последнее звено в цепочке "наука-технология-предпринимательство"? Может быть, и у нас когда-нибудь это тоже будет.
Вопрос: Скажите, каким образом у ученых происходит «копи пейст» генов, в геном бактерий? Я занимаюсь микробиологией: из пробирки – в колбу, из пробирки – в колбу. Каким образом ученые-генетики этим занимаются?
Александр Панчин: Когда я этим занимался во время курсовой работы, это было давно, с тех пор все изменилось. У нас были замороженные бактерии, в которых были определенные гены. У нас были образцы плазмид с определенными генами, замороженные. То есть, уже готовая кольцевая ДНК, где что-то есть, и мы знаем, как эти плазмиды устроены и поэтому можем из нее вырезать.
Мы можем принести эту плазмиду в бактерию, бактерию размножить, потом выделить ДНК, получить эту плазмиду и снова заморозить. Таким образом пополнить объем материала, с которым можно работать. Был подход, что мы могли заказать у какой-то компании, и они синтезировали нам какую-то молекулу с ДНК определенной последовательностью на химическом синтезаторе, и мы могли ее куда-то встроить, или они могли бы сами ее встроить в какую-то плазмиду.
Вопрос (продолжение): Каким образом происходит встраивание?
Александр Панчин: Мы точно знаем последовательность этой плазмиды и какие где сидят нуклеотиды. Мы хотим вырезать кусочек этой плазмиды, подбираем две пары ножниц, чтобы одна разрезала слева, другая разрезала справа, потом мы отделяем маленький фрагмент того, что мы вырезали. После этого смешиваем с чем-нибудь еще, куда мы хотим вставить.
Если хотим перенести кусочек из одной плазмиды в другую плазмиду, мы разрезаем одну плазмиду, отбираем вставку, берем другую плазмиду, разрезаем ее и добавляем туда вставку, а потом добавляем фермент, который сшивает обратно. Есть ферменты, которые природой были придуманы: есть ферменты, которые разрезают в определенных местах, которые сшивают определенные типы разрезов, и всё это мы можем делать в пробирке.
Вопрос (продолжение): В самом начале лекции вы упомянули флуоресцентные микроорганизмы, и вы сказали, что их можно применить для нахождения путей связей нейронов. Какое еще практическое применение у этих флуоресцентных микроорганизмов, помимо картин? Где еще можно применять эту технологию получения флуоресцентных организмов?
Александр Панчин: Самая главная область применения – фундаментальная наука, потому что одна из главных задач для нас – это понять, что делает тот или иной ген, где он работает и так далее. И здесь эта технология абсолютно незаменима. Здесь её самое главное применение. И потом уже вытекают другие технологии, которые уже дальше используются в других областях. Например, придумали, что можно сделать часы, основанные на флуоресцентных белках.
Есть такие флуоресцентные белки, которые со временем тускнеют и можно сделать такую клетку, в ней производится флуоресцентный белок. Если запускается какая-то реакция, сначала он зеленый, а потом он тускнеет. И можно посмотреть, как давно было сделано воздействие на клетку того типа, который вас интересует. Можно таким образом делать детекторы – можно сделать такую систему, что, если, допустим, в питьевой воде присутствует какое-то определенное вещество, то микроорганизм, живущий там, начинает производить флуоресцентный белок. Вот такое применение, например.
Вопрос: Скажите, не существует ли такой опасности, что, когда мы меняем белок-маркер, на который реагирует ВИЧ, то через какое-то время, когда мы у какого-то процента людей его поменяем, ВИЧ тоже мутирует, и получится штамм, который способен поражать два типа клеток? А белок мы не можем менять до бесконечности, потому что рано или поздно он сломается, а он нам зачем-нибудь, да нужен.
Александр Панчин: Да, белок нам зачем-нибудь, да нужен, и даже известно, для чего. У людей, у которых этот белок полностью испорчен, есть побочные эффекты: они в редких случаях даже могу быть смертельны. Когда у вас есть конкретный человек, больной ВИЧ, вы хотите его вылечить – это вариант помочь конкретному пациенту. В будущем появится какой-нибудь другой вирус, который будет иметь другой механизм.
Мы не можем одним махом взять и победить все вирусы будущего, которые могут возникнуть. Понятно, что в будущем придется придумывать новые механизмы от новых вирусов. Чем хорош вариант с использованием CRISP/Cas9 – мы можем делать иммунными клетки от любого вируса. По крайней мере, из тех, которые нам сейчас известны. Появился новый вирус – обновили Cas9 в систему – и всё, возникла устойчивость. Но пока это такая фантастика, которая в будущем, может быть, станет реальностью.
Вопрос: Уже спрашивали по поводу лечения синдрома Дауна. А если у эмбриона на ранних стадиях диагностировали какую-то другую мутацию, не геномного масштаба, а хромосомную или генную? Возможно ли в таком случае использование био-технологических методов лечения?
Александр Панчин: В принципе, да. Для этого и нужны опыты по генной модификации эмбрионов человека. Другой вопрос, что это может быть, как из пушки по воробьям палить. Почему? Почти всегда, если речь идет о генетической мутации в эмбрионе, то проще подобрать здоровый эмбрион.
Всем семьям перед заведением детей рекомендуется пройти генетический анализ на наличие известных генетических заболеваний. После этого, если оба родителя являются носителями некоторого опасного генетического заболевания, то им рекомендуется сделать искусственное оплодотворение.
И при этом мы можем гарантировать, что у эмбриона, который будет имплантирован матери, не будет того заболевания, которое угрожает будущему ребенку. Это более целесообразно, чем лезть с помощью генной инженерии в эмбрион и там что-то менять. Но, в принципе, если бы кому-то захотелось так сделать, технология это позволяет. Но она еще не отработана на человеческих эмбрионах. Всегда бывают разные подводные камни.
Вопрос (продолжение): В природе в изолированных водоемах или на отдаленных территориях встречаются организмы, которые умирают от естественных причин – хищники, болезни. Находили каких-то очень старых птиц, рыб. Все ли организмы стареют?
Александр Панчин: Я привел два примера организмов, которые не стареют.
Реплика: Вы все правильно говорите. Изоляция, отсутствие хищников и проблем у животных двигает эволюционный отбор к увеличению продолжительности жизни. Тот же самый голый землекоп – он живет в огромных норах и защищен от хищников, так же, как «Ночница Брандта» – эта летучая мышь живет 42 года и даже более интересна, чем землекоп.
Александр Панчин: Теперь я понял вопрос! и ответ. (Смех).
Вопрос (продолжение): А эусоциальность никак не влияет?
Реплика: Тут можно предположить, что эусоциальность является благоприятным фактором для животного, таким же, как размер. Большой организм сожрать тяжело. И, соответственно, он лучше защищен. На самом деле, землекопа изучают только три группы последние несколько лет, и мы очень мало о них знаем, в том числе – и про причины смерти.
Александр Панчин: Если верно то, что долго живет только самка, то это еще интереснее, потому что сравнение самки с другими организмами еще более продуктивно в плане поиска. Но я этого точно не знаю, если честно.
Реплика: Там самка приносит потомство с доминирующими самцами, их 3-4. Довольно часто. Доминирующие самцы, видимо, тоже живут долго.
Вопрос: Гены – генетическая эволюция, мы видим разнообразие живого на Земле. Мемы – эволюция знаний, мы видим разнообразие знаний на Земле. А будет ли дальше какой-то мега-эволюционный шаг?
Борис Долгин: Я бы сделал поправку, что если гены это устоявшаяся научная категория, то мемы – это все-таки некая публицистическая метафора.
Александр Панчин: А я не соглашусь. Мемы существуют, они даны нам в эмпирических наблюдениях. Как и любая идея, они подвергаются мутациям и обладают всеми условиями, необходимыми для того, чтобы мы считали объект эволюционирующим. У них есть потомки, потомки могут отличаться. Есть отбор и так далее.
Борис Долгин: Это – метафора, с которой можно пытаться работать, но она не приобрела терминологического статуса.
Александр Панчин: Идея-то в том, что особенности работы нашего мозга от того, какие идеи нам кажутся более привлекательными. Почему нам нравятся больше стихи, допустим, чем та же мысль, изложенная не в стихах? Почему рифма придает определенную привлекательность тексту?
Вот такого рода вещи – особенности строения нашей психики, которые влияют на то, какого рода формы и какого рода идеи распространяются более эффективно в нашей популяции среди людей. Это очень интересно, есть экспериментальные работы, которые посвящены тому, чтобы сравнить: как изменения некоторой идеи влияют на то, что люди хорошо запоминают и дают эту идею дальше, другим людям. Это экспериментальное изучение мутации в мемах. Но не очень много людей этим занимаются.
У Станислава Лемма была супер-фантастическая, страшная вещь, где люди прилетают на какую-то супер-совершенную планету, представляющую собой один-единый кристалл. Он умеет правильно отреагировать на любое внешнее воздействие, постиг все законы физики и достиг абсолютного совершенства. Поэтому неизвестно, куда все может закатиться, может быть, будет сформирована еще какая-нибудь виртуальная реальность, в которой можно будет прекрасно существовать, находясь в полной безопасности. Под землей, в бункере.
Борис Долгин: Судя по тому, как был задан вопрос, речь идет о том, прогнозируете ли Вы появление еще в какой-нибудь области, в какой-нибудь плоскости, какого-то типа единицы, аналогичной генам и мемам, с которой имело бы смысл работать для изучения еще какой-то формы эволюции?
Александр Панчин: Сейчас в голову полез полный бред, например, эволюция корпораций. Огромных сообществ людей. Как человек состоит из клеток, корпорация состоит из людей. И вот эта группа людей может «съесть» другую группу людей. Или размножиться, создав франшизу, например.
Борис Долгин: Строго говоря, какие-то попытки применять теорию эволюции социума относятся к XIX веку, и не то, чтобы это было сильно новым для века XXI. Спасибо за лекцию!
Александр Панчин: Меня попросили подарить книгу за лучший вопрос. Мне кажется, что эта девушка задала лучший вопрос, на который я не знал ответа. Так что книга – ей.
Портал «Вечная
молодость» http://vechnayamolodost.ru
14.06.2016